Je vous avais promis un petit article sur les états d’oxydation concept clé pour comprendre la machinerie de notre corps que vous pourrez appliquer aussi bien à l’échelle atomique qu’à l’échelle cellulaire…
Petit rappel avant de commencer :
1/ Pour calculer les électrons de valence c’est à dire les électrons sur la dernière couche, on se base toujours sur le gaz noble antérieur dans le tableau périodique.
2/ Par contre pour calculer les ions monoatomiques on se base sur le gaz noble dit méta-stable le plus proche.
3/ Pour les métaux en transition on peut se baser sur le tableau périodique quantique et sur la fonction orbitale ce qui n’est pas possible sur le tableau périodique classique. On doit aussi remplir le tableau, l’élément selon la méthode de Kuchlowski pour déterminer la configuration électronique complète du métal en transition. Voir mon article sur le tableau périodique quantique
Antoine de Lavoisier a inventé le terme d’oxydation pour décrire l’effet des atomes d’oxygène sur l’atome central d’un composé tel qu’un oxyde, un hydrate, un acide, ou bien un composé ionique ou covalent.

Antoine de Lavoisier 1743-1790
Ne représente pas la charge ionique mais permet de faire des prédictions d’un composé.
On calcule les états d’oxydation de chaque atome dans une molécule par une échelle d’électronégativité. Comme je l’ai déjà expliqué dans le tableau périodique quantique l’électronégativité est la force attractive de l’atome sur ses électrons lors de la liaison chimique avec une autre espèce.
Chaque atome à une électronégativité déjà calculée en chimie, il s’agit de l’échelle de Pauling :
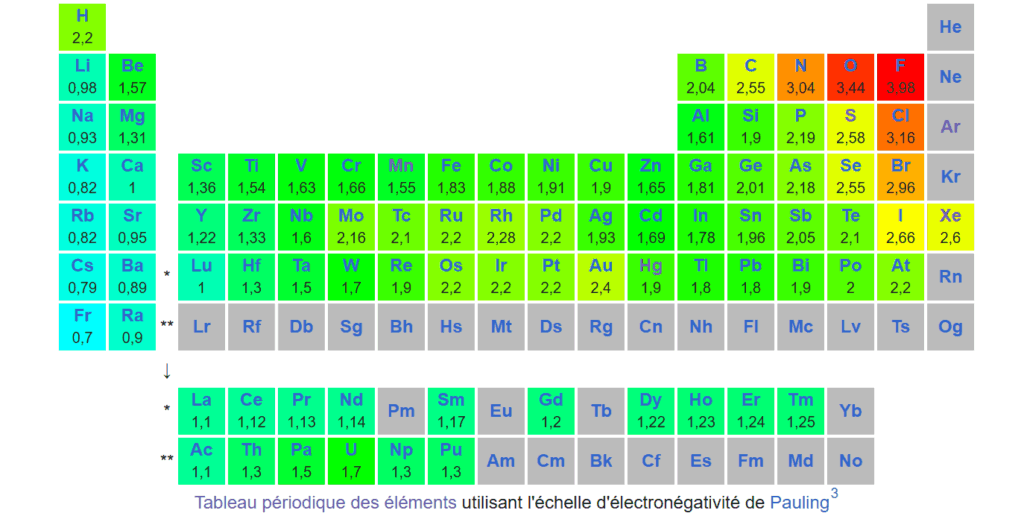
voici un tableau périodique de l’électronégativité. Concrètement à partir d’une structure de Lewis, on va pouvoir replier les liaisons atomiques de deux espèces en fonction de l’atome qui a l’électronégativité la plus forte :

Linus Pauling 1940-1970
Cet article wikipedia résumé en anglais est bien fait : Etat d’oxydation
Il a été travaillé spécialement pour cet article.
Pour chaque atome il faut toujours se reporter à l’échelle de Pauling pour comprendre son OS. Cela va vous demander beaucoup d’attention et de pratique pour vérifier les états de l’oxydation marqués en rouge dans l’article mais c’est un bon exercice.
Règles de base pour comprendre :
L’hydrogène perd un électron quand l’oxygène en gagne deux. Les états sont calculés par un nombre propre appelé OS état d’oxydation. Les transferts ou non transferts d’électrons sont marqués par un trait supplémentaire en rouge. (Parfois on replie la liaison) (Parfois on ne la compte pas, exemple O-O) Connaitre le nombre d’électrons sur la couche externe est important. La plupart du temps la molécule est neutre, l’oxydation s’équilibre pour un composé.
L’oxydation pour notre corps
Passons à la suite, en général le suffixe -ate désigne les composés ont plus de 2 atomes d’oxygène.
Exemple prenez une bouteille d’Evian :
vous allez trouver des sulfates, des nitrates, et des bicarbonates de formules respectives : NO3-, SO4²- et HCO3-. Dans le cas présent ces composés sont des anions dont les atomes centraux sont oxydés, ils ont charge négative. Heureusement vous avez des minéraux tels que le Magnésium et le Sodium cations qui viennent équilibrer dans la bouteille.
La règle générale dans la nature du corps humain veut que plus l’on respire, plus un composé est soumis à l’oxygène plus il vieillit, il s’oxyde.
Pour résumer : La réduction est l’inverse de l’oxydation. Lorsque qu’un atome perd des électrons il s’oxyde car les protons de charge positive ou + prennent le dessus en nombre. Quand un atome gagne des électrons il se réduit car la charge négative prend le dessus.
Dans l’appareil cérébral humain la charge négative correspond à l’état de repos alors que la charge positive correspond à l’influx nerveux libéré donc à un potentiel positif et à un état de réflexion.
Que se passe-t-il lorsque vous mangez, imaginons que vous mangiez un aliment qui contient des glucides, ou plus précisément du glucose (carbohydrates) qui est essentiel pour la vie des métabolites telles que nos mitochondries qui sont l’usine énergétique de nos cellules neuronales.
La glycolyse a lieu ce qui entraine tout d’abord un léger effet d’oxydoréduction calorique(chaleur), le sucre est ingéré digéré par le glycogène et l’action de l’acide pyruvique puis redistribué par le foie ainsi se produit une phosphorylation oxydative c’est à dire que par le mécanisme que j’ai déjà expliqué dans mon article sur l’influx nerveux : l’adénosine diphosphate va se transformer and adénosine triphosphate ce qui correspond au phénomène de respiration cellulaire.
Il va y avoir une différence de concentration ioniques entre les ions sodium et potassium de part et d’autre de la membrane cytoplasmique ce qui va libérer un potentiel électrique par la mise sous tension de l’enzyme d’ATP Synthase qui est un biocatalyseur de nature protéique. Après perméabilisation de la membrane cela va declencher la valeur seuil, puis va générer votre influx nerveux.
Dérivés Réactifs de l’Oxygène et Radicaux Libres
Nos mitochondries vont rejeter ce qu’on appelle des Dérivés Réactifs de l’Oxygène, dont font partie les radicaux libres.
Si ces Dérivés réactifs (peroxyde, ions oxygénés) sont importants dans le système immunitaire pour lutter contre des agents pathogènes ils peuvent être très nocifs en particulier les radicaux libres de par leur nature électronique (couche de valence non appareillé correctement).
Il faut à tout prix éviter une réaction en chaîne c’est à dire qu’un électron qui s’est libéré crée un autre radical et ainsi de suite et forme des bi ou tri radicaux. c’est la principal cause du vieillissement cellulaire.
Pour lutter contre ce vieillissement cellulaire, vous pouvez prendre des anti-oxydants tels que des vitamines ou des oligo-éléments, des polyphénols mais il existe aussi des enzymes spéciales telles que le superoxyde dismutase, ou le glutathion peroxydase qui peuvent empêcher les cellules de muter.
Il y’a d’autres enzymes génétiques cette fois qui permettent de lutter contre le vieillissement et j’en parlerai dans un prochain article sur les différents Acide Ribonucléiques, dits ARN il s’agit de la Télomérase.